- Seminário de lâminas digital
- SLR - Residentes
- Ruana Farias Novaes – Universidade Federal de Minas Gerais, MG
Imagens
História clínica
Paciente masculino, 61 anos de idade, ex-etilista, diabético e hipertenso, recebeu diagnóstico de cardiopatia chagásica crônica há mais de 10 anos. Desde esse momento, evoluiu com dispneia e anasarca impeditivas de suas atividades da vida diária. Sem outra possibilidade terapêutica, foi submetido a transplante cardíaco (TxC) em 19/06/19. Segundo o acompanhamento pós-transplante, foi iniciada administração de tratamento imunossupressor (tacrolimus). O paciente não teve alterações nas primeiras biópsias endomiocárdicas (BEM) de controle, todavia, oito semanas após o TxC, houve rejeição celular ao enxerto e ninhos de T. cruzi no miocárdio. Foi tratado com benzonidazol, com aparente resposta no controle da infecção.
A partir daí, o paciente cursou com diversos episódios de rejeição celular ao TxC, uma delas de grau moderado (2R). Em 04/03/22, constatou-se nova reativação da infecção chagásica, novamente tratada e resolvida com antiparasitário. O paciente manteve-se assintomático até janeiro de 2023, quando apresentou anasarca e dispneia aos grandes esforços (insuficiência cardíaca classe NYHA III). A ultrassonografia mostrou disfunção sistólica biventricular acentuada e derrame pericárdico discreto, com fração de ejeção do ventrículo esquerdo de 30%; eletrocardiograma revelou ritmo supraventricular irregular com períodos de bloqueio atrioventricular Mobitz I, extrassístole supraventricular e paroxismos de taquicardia atrial. Até fevereiro de 2023, a evolução clínica foi de instabilidade hemodinâmica, sendo necessárias intubação orotraqueal, sedação e hemodiálise, com piora progressiva do quadro até 01/03/23, quando apresentou parada cardiorrespiratória em atividade elétrica sem pulso e óbito.
FIGURAS
FIGURA 1 – REJEIÇÃO E REATIVAÇÃO (1:50µm), H&E
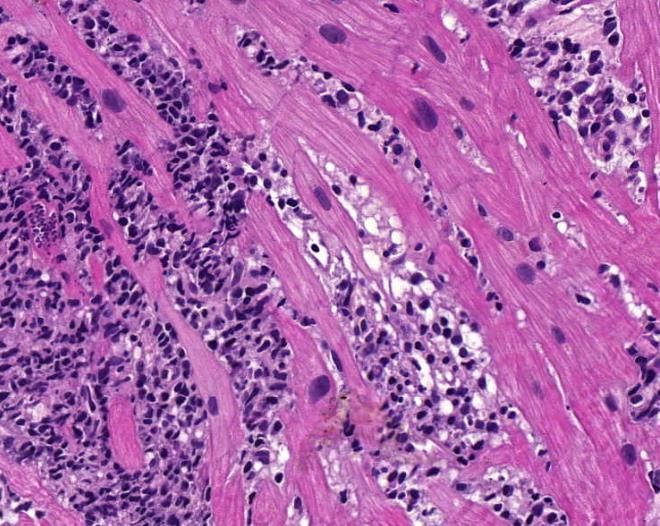
BEM em 04/03/22. Rejeição celular moderada (2R). Focos múltiplos de infiltrado de mononucleares no miocárdio associados à agressão/destruição de miocardiócitos. Reativação da infecção pelo T. cruzi (ninho de amastigotas, no destaque).
FIGURA 2 – ASPECTO MACROSCÓPICO DO CORAÇÃO DA AUTÓPSIA
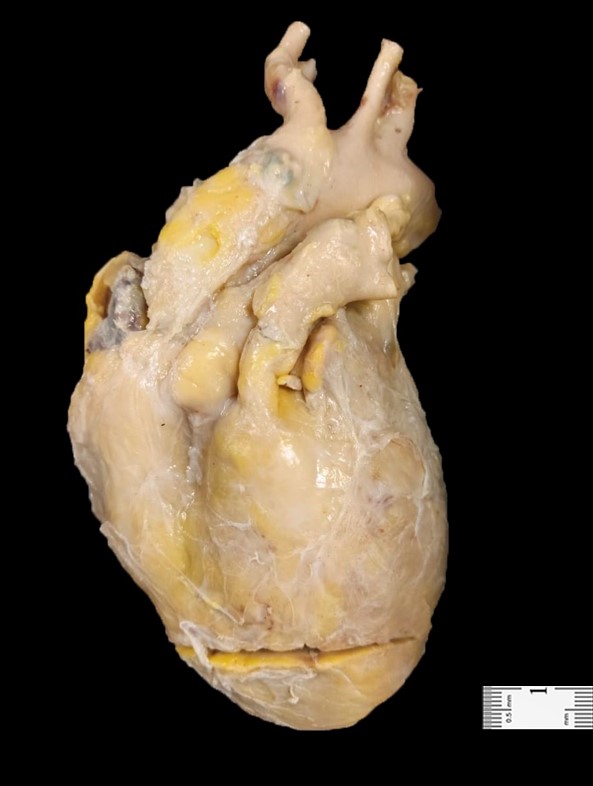
FIGURA 3 – ASPECTO MICROSCÓPICO DO CORAÇÃO DA AUTÓPSIA, H&E
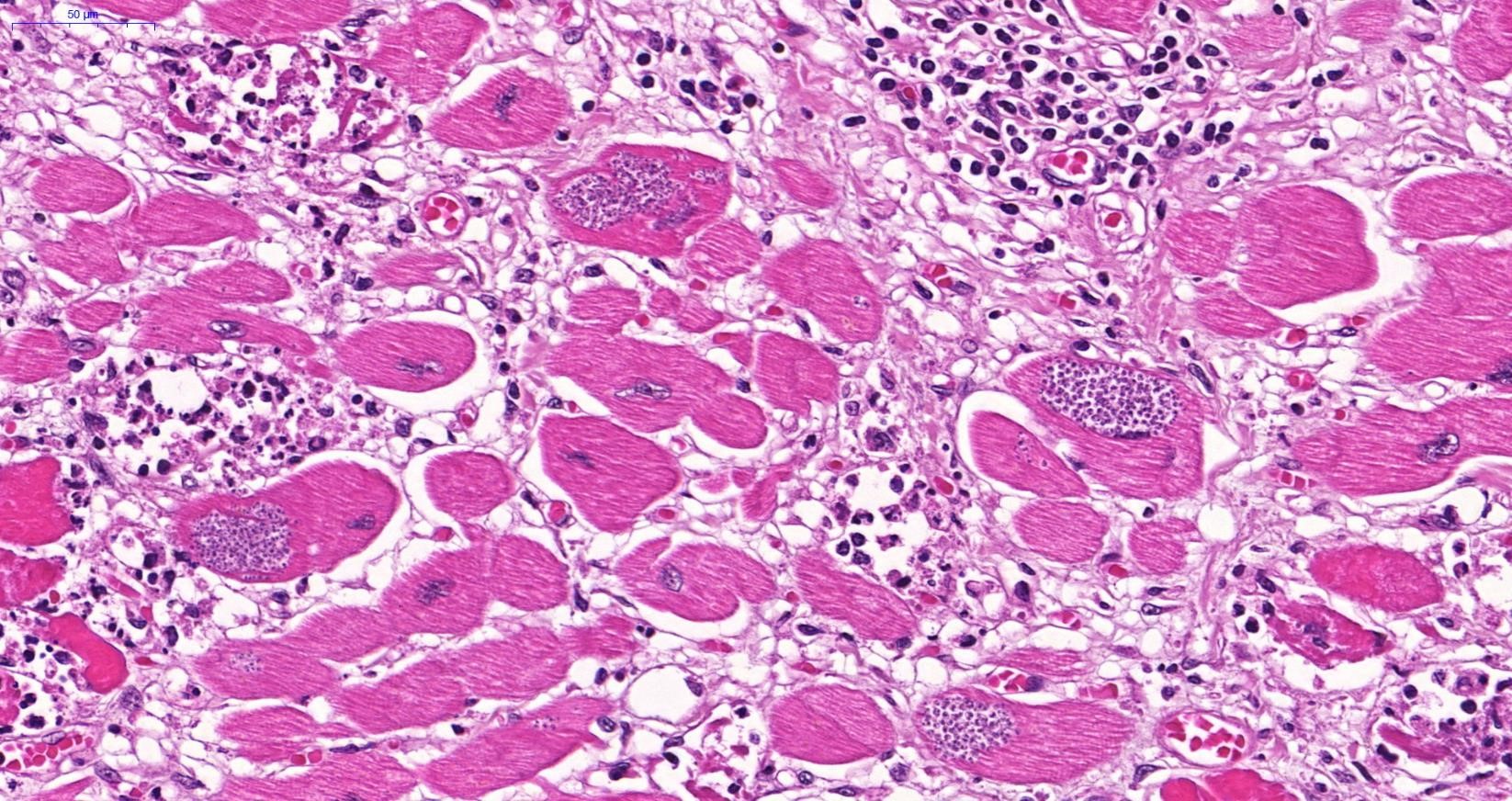
Corte de miocárdio no coração implantado, mostrando numerosos ninhos de amastigotas (setas pretas) e destruição de alguns miocardiócitos (setas azuis)
FIGURA 4 – TRICRÔMICO DE MASSON DA AUTÓPSIA
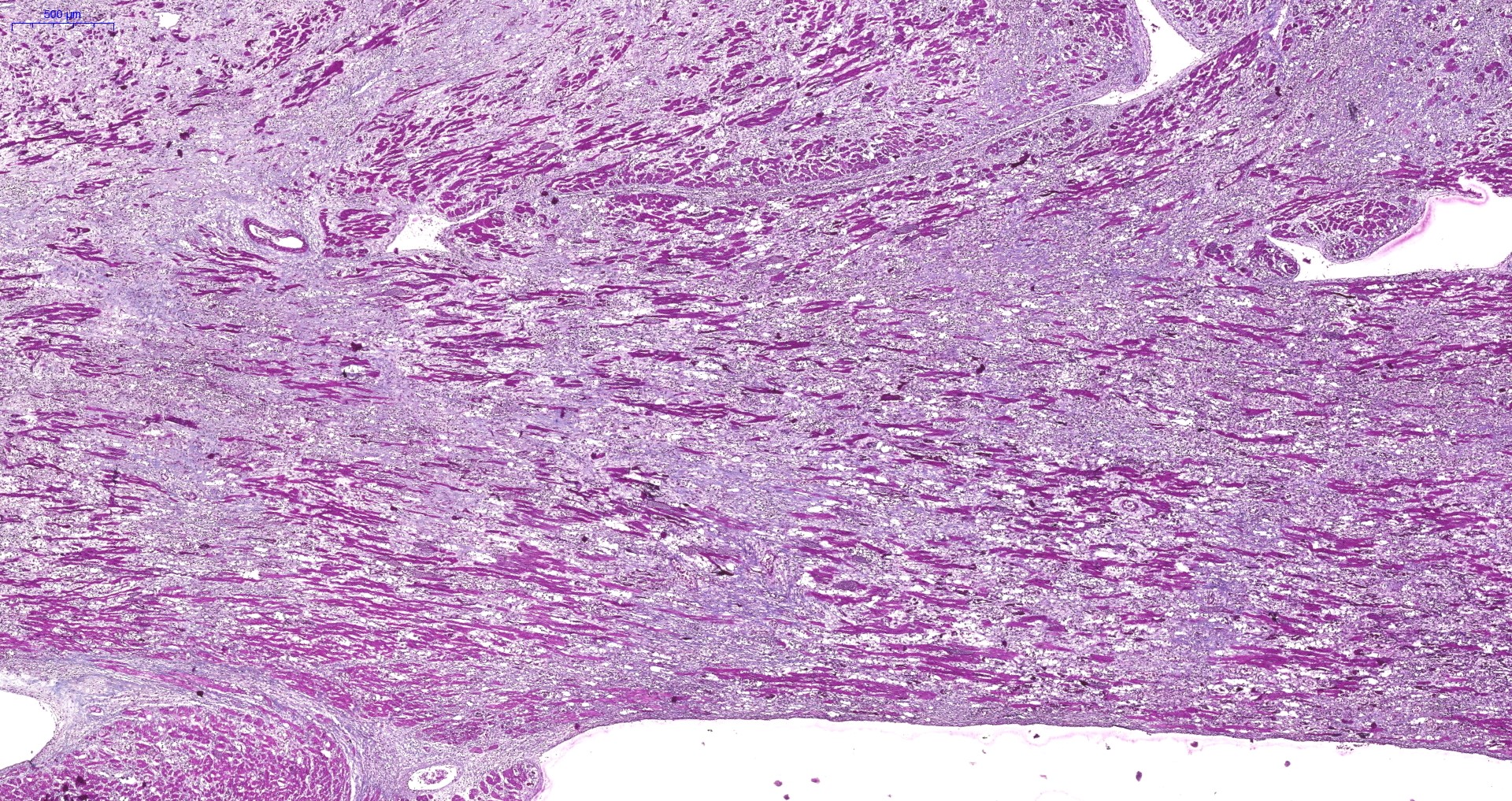
Corte da parede do VE mostrando extenso desaparecimento de miocardiócitos e neoformação conjuntiva endo e perimisial.
FIGURA 5 – MICROSCOPIA ELETRÔNICA
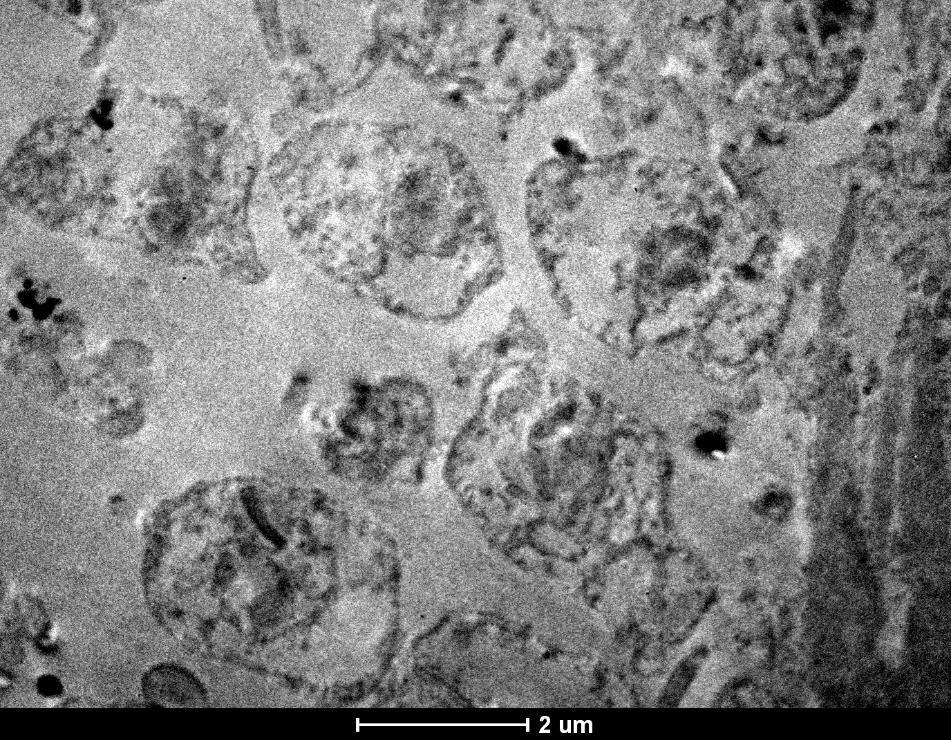
Corte evidenciando amastigotas e cinetoplastos.
FIGURA 6 – ENSAIO DE PCR PARA TIPAGEM MOLECULAR DE T. CRUZI
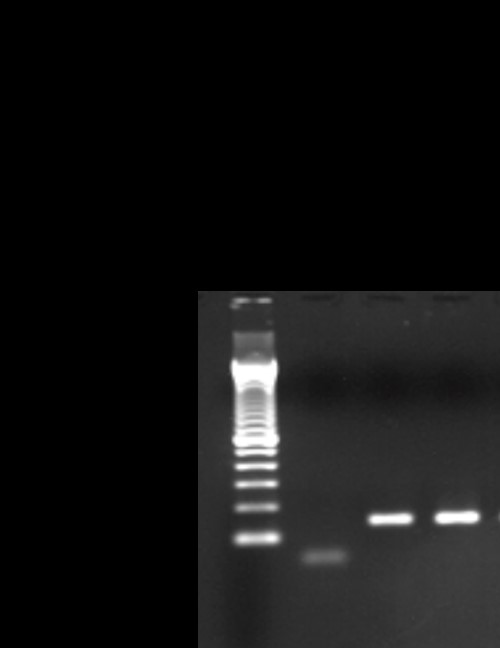
PCR para 24Sα origina um produto de 125 pares de base (pb) para a cepa TcII.
Referências bibliográficas:
- VICENTE et al. Possible role of an adrenal parasite reservoir in the pathogenesis of chronic Trypanosoma cruzi myocarditis. Transactions of the Royal Society of Tropical Medicine and Hygiene, v. 87, n. 5, p. 552–554, 1 set. 1993.
- WARD, A. I. et al. In Vivo Analysis of Trypanosoma cruzi Persistence Foci at Single-Cell Resolution. mBio, v. 11, n. 4, 25 ago. 2020.
- BURGOS, J. M.; ALTCHEH, J.; BISIO, M.; DUFFY, T.; VALADARES, H. M. ET AL. Direct molecular profiling of minicircle signatures and lineages of Trypanosoma cruzi bloodstream populations causing congenital Chagas disease (2007). International Journal for Parasitology, v.37, n. 12, p.1319-1327.
- MAGALHÃES LMD, GOLLOB KJ, ZINGALES B, DUTRA WO. Pathogen diversity, immunity, and the fate of infections: lessons learned from Trypanosoma cruzi human-host interactions (2022). Lancet Microbe 3(9):e711-e722.
- VALADARES, H. M.; PIMENTA, J. R.; DE FREITAS, J. M.; DUFFY, T.; BARTHOLOMEU, D. C.; DE PAULA, O. R.; CHIARI, E.; MOREIRA, M. D. A. C.; FILHO, G. B.; SCHIJMAN, A. G.; FRANCO, G. R.; MACHADO, C. R.; PENA, S. D.; MACEDO, A. M. Genetic profiling of Trypanosoma cruzi directly in infected tissues using nested PCR of polymorphic microsatellites (2008). International Journal for Parasitology, v. 38, n.7, p. 839-55.
- ZINGALES, B.; ANDRADE, S. G.; BRIONES, M. R.; CAMPBELL, D. A.; CHIARI, E. et al. A new consensus for Trypanosoma cruzi intraspecific nomenclature: second revision meeting recommends TcI to TcVI (2009). Memórias do Instituto Oswaldo Cruz, v.104, n.7, p.1051-1054.
- BILLINGHAM, M.; KOBASHIGAWA, J. A. The Revised ISHLT Heart Biopsy Grading Scale. The Journal of Heart and Lung Transplantation, v. 24, n. 11, p. 1709, nov. 2005.
- TAN, C. D.; BALDWIN, W. M.; RODRIGUEZ, E. Update on Cardiac Transplantation Pathology. v. 131, n. 8, p. 1169–1191, 1 ago. 2007.
- MOREIRA, M. DA C. V.; RENAN CUNHA-MELO, J. Chagas Disease Infection Reactivation after Heart Transplant. Tropical Medicine and Infectious Disease, v. 5, n. 3, p. 106, 29 jun. 2020.
- BRASILEIRO FILHO, G. Bogliolo patologia. 10. ed. Rio de Janeiro: Guanabara Koogan, 2022, 1573.
- CARVALHO, V. et al. Heart Transplantation in Chagas’ Disease – 10 Years After the Initial Experience. Circulation, v. 94, n. 8, p. 1815–1817, 15 out. 1996.
- CASTRO, I. et al. I Diretriz Latino-Americana para o Diagnóstico e Tratamento da Cardiopatia Chagásica. Arquivos Brasileiros de Cardiologia, v. 97, n. 2, p. 01-48, 2011.
- LIMA et al. Transcriptomic analysis of benznidazole-resistant and susceptible Trypanosoma cruzi populations. Parasites & Vectors, v. 16, n. 1, 22 maio 2023.
Diagnóstico final e handout:
A autópsia, realizada em 01/03/23, teve como principais achados (1) no coração: (a) peso e dimensões de 520g e 13,0 x 10,0 x 10,0cm; (b) forma globosa, com dilatação moderada de átrios e ventrículos; (c) trombose recente, em organização, no átrio direito e na ponta do ventrículo esquerdo; (d) reativação da infecção pelo Trypanosoma cruzi, com grande número de ninhos de amastigotas em miocardiócitos em átrios e ventrículos – confirmação de amastigotas foi feita por microscopia eletrônica e RT-PCR; (e) grande número de focos de infiltrado inflamatório de mononucleares no epicárdio, no endocárdio e, sobretudo, no miocárdio, com extensa agressão e destruição de miocardiócitos; em alguns locais, houve perda de 60-70% dessas células; (f) neoformação conjuntiva recente, com poucas fibras colágenas, no perimísio e no endomísio, resultando em desorganização da arquitetura tridimensional dos fascículos musculares e na descontinuidade dos miocardiócitos. Não se encontraram amastigotas em estruturas consideradas reservatórios, como baço, medula óssea, veia central das suprarrenais, camada muscular de cólon e esôfago, musculatura esquelética e pele1,2.
Nos demais órgãos, encontraram-se: (2) necrose hemorrágica maciça recente no fígado, com destruição extensa de hepatócitos nas zonas 2 e 3 dos ácinos hepáticos; (3) necrose tubular aguda em ambos os rins, além de cicatrizes de infartos antigos e de pielonefrite crônica; (4) hemorragia na submucosa de esôfago, estômago e intestinos delgado e grosso, com pequena quantidade de sangue na luz intestinal; (5) congestão e edema pulmonares moderados, além de abscesso de 2,0 x 1,8cm recente com fungos do gênero Aspergillus; e (6) encefalopatia hipóxico-isquêmica, evidenciada por isquemia de neurônios e rarefação de células de Purkinje, do neurópilo e do espaço perivascular.
A caracterização molecular do T. cruzi, que inclui seis discrete typing units (DTUs) (TcI-VI), foi feita por nested PCR (Burgos et al., 2007; Valadares et al., 2008), para discriminação das cepas TcI (fragmentos de 30, 81 e 264pb) e TcII (fragmentos de 81 e 212pb). Como padrões de comparação foram utilizados DNA de cepas linhagens TcIII-TcIV e TcV-TcVI, tendo sido identificada a cepa TcII. Magalhães et al. (2022) mostraram predomínio da cepa TcII no Brasil e fortaleceram a associação da diversidade genética do parasito com o curso da infecção e o desenvolvimento de formas graves, como a cardiopatia associada a essa cepa3,4,5,6.
Após TxC, os pacientes são monitorados para rejeição do enxerto com biópsias endomiocárdicas seriadas. A rejeição pode ser celular ou mediada por anticorpos. A rejeição do tipo celular, mais frequente, manifesta-se por infiltrado de mononucleares (linfócitos e macrófagos), com ou sem agressão/destruição de miocardiócitos7,8.
Rejeição celular ao enxerto ocorre em 70% dos casos no primeiro ano após o transplante, sendo responsável por cerca de 10% dos óbitos nos receptores, sem diferença de incidência entre pacientes chagásicos e não chagásicos. Tal rejeição é classificada pela International Society of Heart and Lung Transplantation como focal ou difusa, com ou sem dano muscular, e a gravidade da rejeição é determinada pelo grau de agressão às miocélulas. Graus mais elevados de rejeição requerem tratamento imunossupressor mais agressivo7,9.
Em pacientes com doença de Chagas submetidos a TxC, a interpretação de BEMs traz dificuldade adicional. Como o infiltrado inflamatório mononuclear e a agressão às miocélulas são comuns na reativação da infecção chagásica e na rejeição celular mais intensa, o diagnóstico diferencial dessas duas condições se torna crucial e desafiador8,9. O tratamento antiparasitário tem riscos próprios e a imunossupressão mais vigorosa favorece a proliferação de micro-organismos. Ao examinar BEMs de pacientes chagásicos transplantados, portanto, o patologista deve estar atento.
Rejeição ao enxerto e reativação da infecção chagásica podem ocorrer várias vezes, mesmo quando o paciente é tratado corretamente. A rejeição costuma preceder a reativação, e a maioria dos pacientes têm pelo menos um episódio de rejeição antes de ocorrer a reativação. A vigilância ativa e alto nível de suspeição são recomendados, visto que os sintomas são similares e podem coexistir, com sobreposição dos achados histopatológicos8,9.
A reativação da infecção chagásica pós-transplante cardíaco constitui fator notoriamente agravador e pode ser considerada o marco para o desenvolvimento de um novo quadro de insuficiência cardíaca, como no presente caso. Tal reativação pode ocorrer em tempos variados após o TxC; neste paciente, ocorreu dois meses após o transplante. Em geral, o tratamento com medicamentos anti-T. cruzi resulta na eliminação dos parasitos9. No paciente, no entanto, sucessivas administrações de benzonidazol não erradicaram a infecção, possibilitando a proliferação e grave comprometimento do miocárdio, o que resultou em extensa e acentuada miocardite, com destruição considerável do miocárdio.
Nesse contexto, o caso apresentado é desafiador e instigante. Cerca de 40 meses após a reativação, o coração mostrou extensa miocardite ativa, destruição de miocardiócitos e fibrose, lesões semelhantes às vistas na fase crônica da doença de Chagas. Assim, parece ter ocorrido a mesma sequência evolutiva da infecção natural pelo T. cruzi, em que, após longo tempo da introdução dos protozoários, surge inflamação crônica com destruição de miocardiócitos e fibrose10. O que este caso difere da doença de Chagas natural é a riqueza de parasitos no coração, indicador da falência do organismo em destruí-lo, mesmo com medicação em princípio efetiva e sem reservatório confirmado.
Considerando que nova cardiopatia chagásica crônica após transplante cardíaco nunca foi registrada11,12 e que, em concordância com Lima et al. (2023), enzimas de defesa antioxidantes, como ascorbato peroxidase e superóxido desmutase de ferro, podem conferir fenótipo de resistência ao benzonidazol para o T. cruzi13. Neste paciente, há achados morfológicos e clínicos de que, além da reativação da infecção, houve resposta inflamatória crônica persistente, destrutiva e fibrosante no miocárdio, ou seja, uma nova doença. O encontro de cepa mais patogênica (DTU TcII) do parasito reforça a possibilidade de inflamação crônica no coração implantado. O quadro permanece em estudo pela equipe responsável.




 Programação completa
Programação completa
 Palestrantes confirmados
Palestrantes confirmados
 Comissões
Comissões
 Trabalhos e seminários
Trabalhos e seminários
 Localização do evento
Localização do evento
 Valores
Valores









