- Seminário de lâminas digital
- SLR - Residentes
- Beatriz Sayuri Vieira Ishigaki – A. C. Camargo Câncer Center, SP
Imagens
Resumo da história clínica
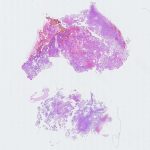
Paciente do sexo masculino, 31 anos, sem antecedentes relatados, evoluindo com história de cefaleia refratária e hemisparestesia direita com evolução de 1 ano. À investigação, foi realizada ressonância magnética, a qual revelou lesão nodular cerebral heterogênea e parcialmente cística em região frontal esquerda, medindo 1,5cm no maior eixo.
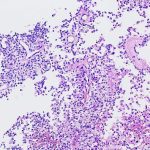
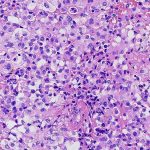
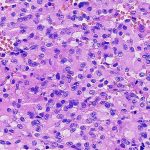
Foi submetido à ressecção cirúrgica no serviço de origem, com diagnóstico histopatológico de neurocitoma central. Solicitada segunda opinião diagnóstica para programação terapêutica em hospital de referência, no qual foi realizado o diagnóstico de neoplasia neuroepitelial com diferenciação glial, sem outras especificações, baseado em achados histológicos e imuno-histoquímicos. À microscopia convencional, foi identificada densa proliferação de células pouco atípicas, com núcleos arredondados e citoplasma eosinofílico e em geral amplo, arranjadas em manto ou em pseudorrosetas perivasculares, com crescimento expansivo e infiltrativo, e com proeminente microvascularização própria. Foram identificadas até 3 figuras de mitose/10 campos microscópicos contíguos de grande aumento (400x/0,56mm de diâmetro) e pequeno foco microscópico de necrose, sem proliferação microvascular com endotélio reativo e estratificado associado. Ao exame imuno-histoquímico realizado nesta instituição, foi demonstrada positividade consistente para S100, GFAP e Olig2, positividade fraca para sinaptofisina, positividade focal (raras células) para SOX10, positividade parcial para ciclina D1 e imunonegatividade para todos os demais marcadores (IDH1 (R132H – clone H09), cromogranina A, CD34, PAX2, PAX8, NeuN, EMA, TTF1, D2-40, CK8/18, AE1/AE3, L1CAM e neurofilamento. A expressão de H3K27me3 e ATRX foi preservada, assim como p53 e p16 foram não aberrantes (padrão selvagem). O índice proliferativo estimado por ki67 (MIB-1) foi estimado em torno de 2 – 3%.
Mediante estes achados e após discussão anatomoclínica, o material emblocado em parafina foi submetido a exames moleculares complementares. O sequenciamento genético, realizado na mesma instituição revisora (sequenciamento paralelo em larga escala – TSO500), identificou fusão EWSR1 (éxon 8)::PATZ1 (éxon 1) (137 leituras), com baixa carga mutacional tumoral (TMB) (1 mutação/Mb) e estabilidade de microssatélites, já sendo proposto o diagnóstico de Tumor neuroepitelial com fusão de PATZ1. Em paralelo, o perfil de metilação do DNA foi realizado em instituição parceira e também foi compatível com o diagnóstico proposto de Tumor neuroepitelial com fusão de PATZ1.
Imagens
Referências
- Alhalabi KT et al. PATZ1 fusions define a novel molecularly distinct neuroepithelial tumor entity with a broad histological spectrum. Acta Neuropathol. 2021 Nov;142(5):841-857. doi: 10.1007/s00401-021-02354-8. Epub 2021 Aug 21. PMID: 34417833; PMCID: PMC8500868.
- Siegfried A, Rousseau A, Maurage CA, Pericart S, Nicaise Y, Escudie F, Grand D, Delrieu A, Gomez-Brouchet A, Le Guellec S, Franchet C, Boetto S, Vinchon M, Sol JC, Roux FE, Rigau V, Bertozzi AI, Jones DTW, Figarella-Branger D, Uro-Coste E. EWSR1-PATZ1 gene fusion may define a new glioneuronal tumor entity. Brain Pathol. 2019 Jan;29(1):53-62. doi: 10.1111/bpa.12619. Epub 2018 Jul 13. PMID: 29679497; PMCID: PMC8028282.
- Fontaine A, Basset L, Milin S, Argentin J, Uro-Coste E, Rousseau A. Tumeur neuroépithéliale avec fusion PATZ1 – à propos d’un cas et mise au point sur une entité mal définie [Neuroepithelial tumor with PATZ1 fusion – case report and focus on an ill-defined entity]. Ann Pathol. 2024 Feb 9:S0242-6498(24)00006-3. French. doi: 10.1016/j.annpat.2024.01.002. Epub ahead of print. PMID: 38341312.
- Ene A, Di J, Neltner JH, Pittman T, Arnold SM, Kolesar JM, Villano JL, Bachert SE, Allison DB. Case report: A unique presentation of a high-grade neuroepithelial tumor with EWSR1::PATZ1 fusion with diagnostic, molecular, and therapeutic insights. Front Oncol. 2023 Jan 31;13:1094274. doi: 10.3389/fonc.2023.1094274. PMID: 36816978; PMCID: PMC9928596.
- Kim H, Lee K, Phi JH, Paek SH, Yun H, Choi SH, Park SH. Neuroepithelial tumor with EWSR1::PATZ1 fusion: A literature review. J Neuropathol Exp Neurol. 2023 Oct 20;82(11):934-947. doi: 10.1093/jnen/nlad076. PMID: 37804108.
Diagnóstico final
Tumor neuroepitelial com fusão de PATZ1.
Handout
O tumor neuroepitelial com fusão de PATZ1 é um tipo tumoral recente, não reconhecido pela classificação de 2021 da WHO, porém já identificado como entidade com perfil de metilação próprio e distinto das demais neoplasias (1,4). Costuma ter maior incidência em crianças e jovens adultos, com idade média de 20.4 anos. É uma entidade de difícil diagnóstico pelas suas características morfológicas variadas e não específicas. Na maioria dos casos, são proliferações densamente celulares de céluas de formato e padrão variáveis, com núcleo monomórfico, morfologia glioneuronal e localização ventricular. Pode ainda apresentar pseudorrosetas perivasculares de tipo ependimária, características astroblásticas, densa rede de reticulina, ocasionais microcalcificações e rica rede vascular, com vasos sanguíneos hialinizados (2). Pode apresentar características de baixo grau, como as citadas anteriormente, e até mesmo alto grau, com atipia intensa, necrose em paliçada, núcleos pleomórficos e hipercromáticos, além de aumento no número de mitoses atípicas. Há expressão variável de Olig2, sinaptofisina e GFAP (3). Devido à heterogeneidade histológica e ao padrão neuroepitelial polifenotípico, vários outros diagnósticos diferenciais possíveis podem ser considerados, como glioblastoma, ependimoma, tumores embrionários, xantoastrocitoma pleomórfico, gliomas e tumores neuroepiteliais com diferenciação sarcomatosa (5). Apesar de sua variabilidade, tal neoplasia é geneticamente definida e se diferencia dos demais tumores do sistema nervoso central pela presença da fusão do gene PATZ1 com genes parceiros (como EWSR1 e MN1), em geral reguladores de processos celulares, mais comumente causada por inversão em cromossomo 22. Quanto ao prognóstico, costuma ser comparável ao de neoplasias de grau histológico intermediário. O diagnóstico definitivo requer a integração de todos os achados anatomopatológicos, inclusive moleculares (1).
O paciente deste caso foi submetido à nova abordagem cirúrgica para retirada de remanescente lesional, com achados anatomopatológicos similares. Está em acompanhamento, e, devido ao crescimento de nova lesão, há avaliação para tratamento complementar.





 Programação completa
Programação completa
 Palestrantes confirmados
Palestrantes confirmados
 Comissões
Comissões
 Trabalhos e seminários
Trabalhos e seminários
 Localização do evento
Localização do evento
 Valores
Valores









